Documents réglementaires
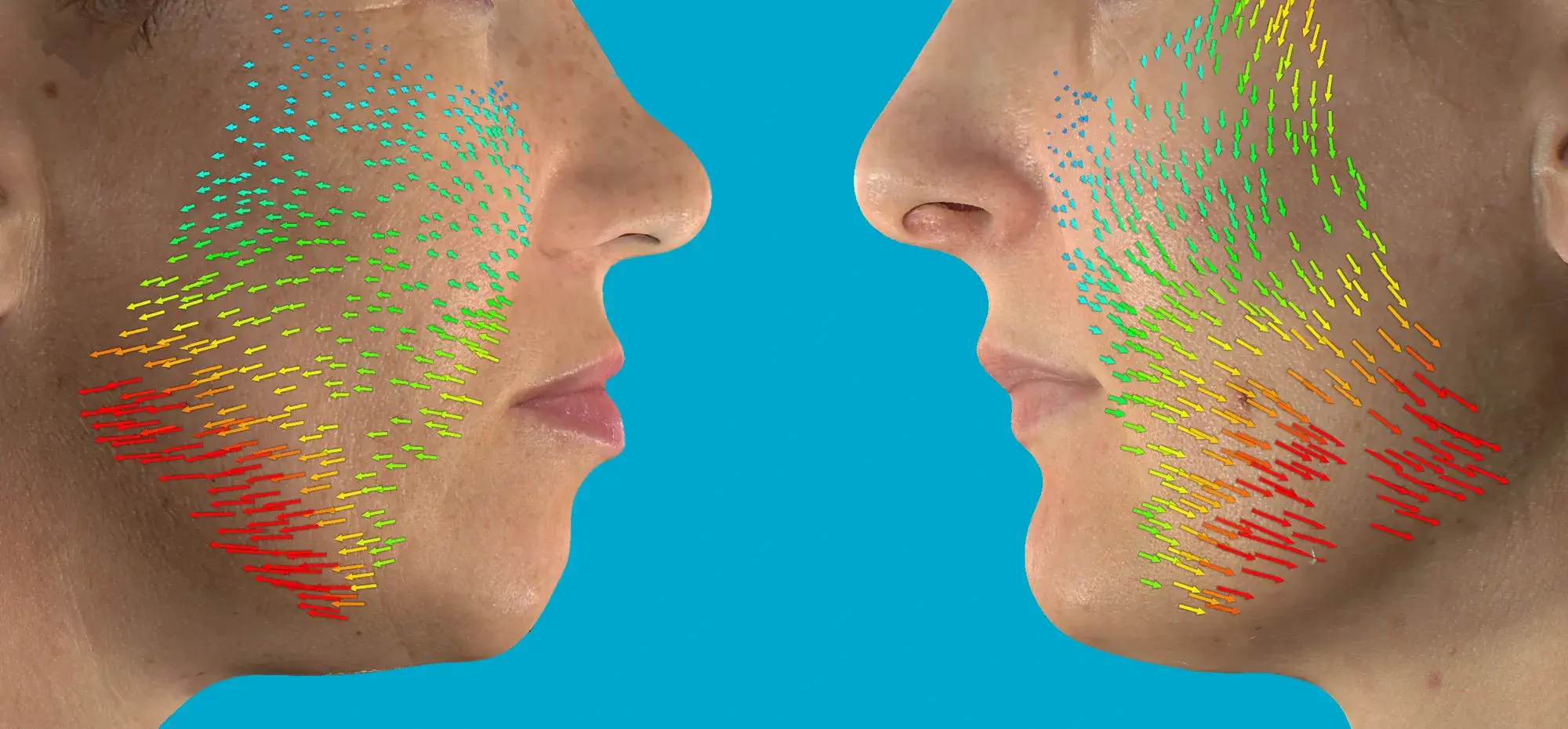
Avec l’aimable autorisation du Dr. Lukasz Preibisz
Préparation des documents cliniques requis par les comités d’éthique, les autorités de santé compétentes et les agences d’autorisation de mise sur le marché
- Synopsis, protocoles/CIP et amendements
- Rapports d’études cliniques (CIR/CSR)
- Formulaires pour les case reports (CRF)
- Formulaires des comités d’éthique et des autorités de santé compétentes
- Brochures de l’investigateur (IB)
- Plaquettes d’information pour les patients
- Formulaires pour le consentement éclairé des patients (ICF)
- Manuels sur les procédures cliniques
- Rapport d’évaluation clinique (CER) pour les dispositifs médicaux
- Réponse aux lettres de déficience
- Désignation des produits: résumé des caractéristiques (SmPC) et mode d’emploi (IFU)
- Modules cliniques du dossier d’autorisation de mise sur le marché (aperçu général, résumé de la sécurité et de l’efficacité clinique) pour les organismes notifiés européens et la FDA
Types d’études cliniques:
- Etudes de phases I-IV (produits pharmaceutiques)
- Etudes pilotes/pivotales/PMCF (dispositifs médicaux)
- Etudes et programmes non-interventionnels (NIS/NIP)
- Registres
- Essais entrepris à l’initiative de l’investigateur (IIT)